糖尿病と肥満
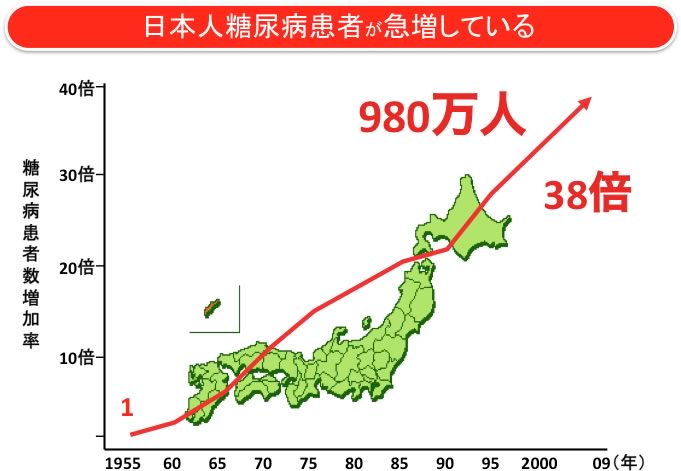
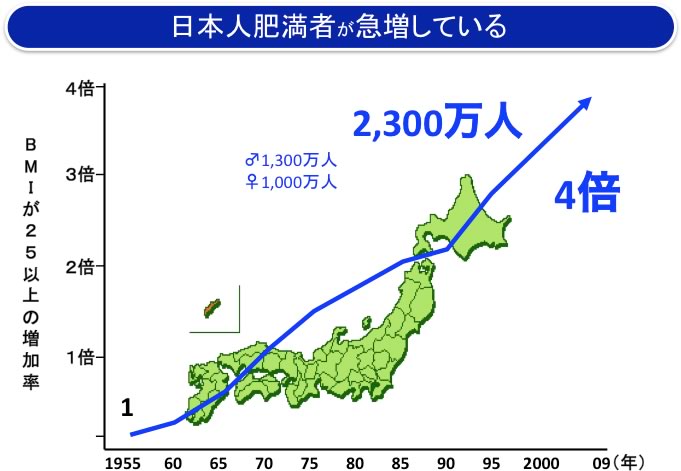
現在、国内に糖尿病の患者さんは約980万人おり、最近の50年間で38倍に増加しています。これに境界型、予備軍を合わせると2,000万人を超えており、人口が1億3,000万であることを考えると、驚異的な数字です(図1、左グラフ)。一方、肥満度(BMI)が25以上の肥満者は2,300万人いて、やはり最近の50年間に4倍に増加しています(図1、右グラフ)。従って、糖尿病と肥満症は今や国民病と言えます。
メタボリック症候群
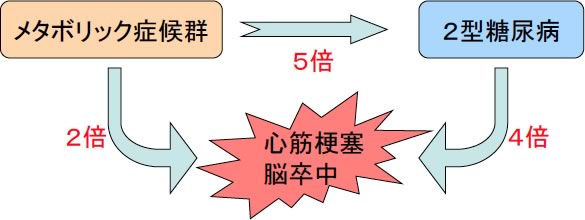
メタボ”というと、中年男性の代名詞のように使われることがあり、今ひとつ深刻さに欠けますが、実は大変重大な病態です。メタボリック症候群になるだけで心筋梗塞や脳卒中のリスクは2倍に増加し、糖尿病のリスクは5倍になります。また、糖尿病になると心筋梗塞や脳卒中のリスクは4倍に増えますので、結局メタボリック症候群は私たちの寿命に大きく影響する危険な状態なのです(図2)。
当研究室の標的臓器
全身のエネルギー代謝調節に重要な役割を果たす臓器としては、脳、肝臓、膵臓、骨格筋、脂肪組織などがありますが、代謝シグナル解析分野では膵臓のランゲルハンス島(ラ氏島)の中に10〜30%程度含まれるα細胞と、脳の視床下部に注目して研究を行っています。これは後述するように、グルカゴンの異常が糖尿病の病態に密接に関わっていることを見出したことと、過食による肥満が糖尿病の悪化因子であることが明らかであるからです。
そこで、糖尿病、グルカゴン研究グループでは小林講師を中心に、グルカゴンの正確な測定系の確立と、それを用いたグルカゴン測定の糖尿病診断指標への臨床応用、グルカゴン基礎研究の道具としての生理的なα細胞特徴を保持する新規α細胞株の樹立、さらにはα細胞特異的な遺伝子改変マウスを作製し、糖尿病病態の分子レベルでの解明を目指しています。これらの研究成果は将来の糖尿病に対する新たな予防法、治療法の開発につながることが期待されます(図3上)。
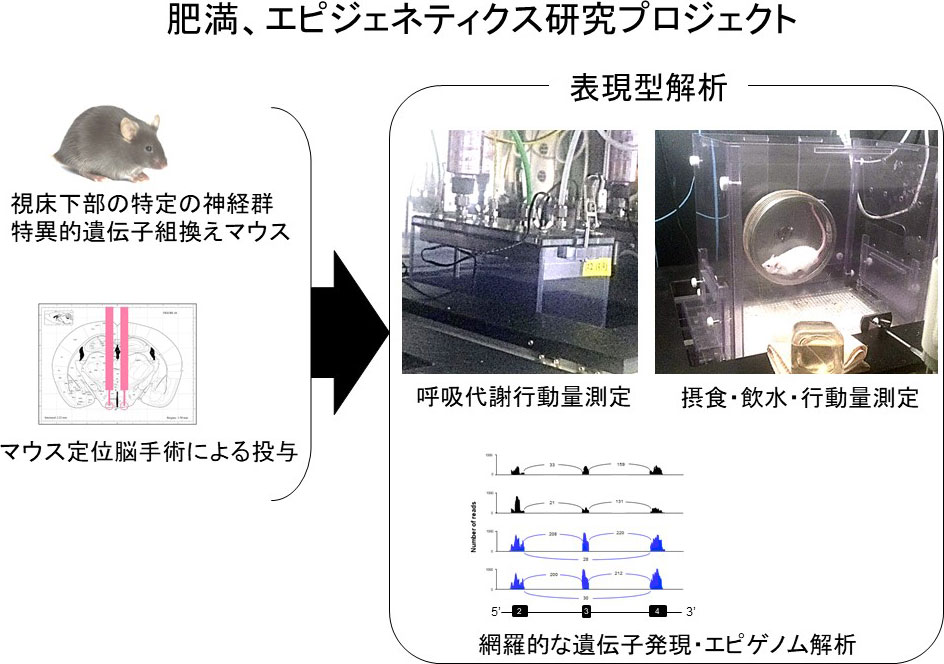
一方、河野助教を中心とする肥満、エピジェネティクス研究グループでは、摂食やエネルギー代謝の調節に重要な視床下部において特異的に遺伝子を改変したマウスを作製し、肥満や生活習慣病のなり易さを研究しています。特に後天的な遺伝子の修飾であるエピジェネティクスは近年急激に増加している肥満が遺伝子の変異ではなく、生活習慣の変化による後天的な理由で起きていることの説明にもなり、将来の肥満症対策に重要な知見が期待できます。また、マウスやラットに定位脳手術を行って、視床下部の特定の神経核に遺伝子や薬剤を投与する実験も行っています(図3下)。
糖尿病、グルカゴン研究プロジェクト
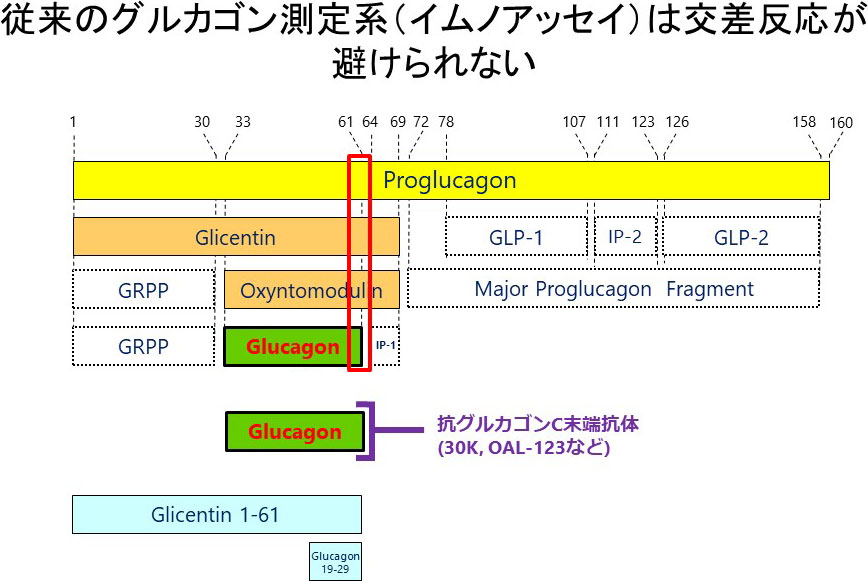
これまで、糖尿病の研究はインスリンを中心に進められ、2型糖尿病は肝臓、骨格筋、脂肪組織といった末梢臓器におけるインスリン抵抗性とインスリンを分泌する膵β細胞の障害(インスリン分泌不全)が原因であるとされてきました。一方で、グルカゴン研究は、グルカゴン自体が合成されてくる過程で生じる複数の類似ペプチドの存在により、グルカゴンを特異的に測定することが困難であったため、インスリン研究に比べ、大きく遅れてきました(図4)。そこで当研究室では、質量分析法やサンドイッチELISA法を用いた新しいグルカゴンの測定系の開発を進めてきました。これらの測定系で正確にグルカゴンを評価すると、糖尿病の病態にα細胞の障害(グルカゴン過剰分泌)も関わっていることが明らかとなってきました(図5左)。さらにグルカゴンを抑制すると、糖尿病の病態が改善することも証明されています。しかしながら、なぜ糖尿病でα細胞の異常が起きるのか、そのメカニズムは明らかになっていません。そこで当研究室では、α細胞機能に関わる種々の遺伝子をα細胞のみで改変させた遺伝子改変マウスを作製し、α細胞障害メカニズムを分子レベルで解明することを目指しています。最近、α細胞に発現する糖輸送体であるSGLT1とGLUT1がグルカゴン分泌調節に重要で、糖尿病ではこれらの輸送体の発現に異常が見られることを報告した論文がMolecular Metabolism誌の表紙になりました(図5右)。さらに、グルカゴンを新たな治療標的とした糖尿病治療法の開発と、グルカゴンを新たな診断指標とした糖尿病の病態診断法の開発を目指し、モデル動物を用いた基礎研究とヒト検体を用いた臨床研究の2本立てでプロジェクトを進めています。
肥満、エピジェネティクス研究プロジェクト
肥満を基盤として発症するメタボリック症候群は重大な疾患に移行するリスクが高いことから、肥満を予防する必要があります。私たちの体のエネルギー恒常性は、摂食量とエネルギー消費量のバランスで保たれており、前者が後者を上回ると、肥満になります。この両者をコントロールしているのが脳の視床下部です。一定に保たれるはずの摂取と消費のバランスが、なぜ乱れて肥満になってしまうのかについては、いまだ十分には分かっていません。
我々の体には、両親から引き継いだ設計図であるDNAの塩基配列に加えて、時期や状況に合わせて設計図の使い方を調整する仕組みであるエピゲノム修飾が備わっています。エピゲノム修飾は、環境や生活習慣に対する適応機構でもあるため、生活習慣による肥満発症の分子機構である可能性があります。実際に、当研究室では、視床下部におけるDNAメチル化修飾やRNAメチル化修飾が正常に調節されないと、摂食行動やエネルギー代謝調節に異常が起きることを見出しています。
また、当研究室では、ウイルスベクターや薬物の脳内投与により特定のニューロンでのみ遺伝子やエピゲノム修飾を操作したマウスを用いて、摂食行動や代謝、遺伝子発現、エピゲノム修飾などの表現型の解析を行っています(図6)。詳細なメカニズムを解明し、今後の抗肥満薬、あるいはメタボリック症候群に対する新しい治療法の開発につなげたいと考えています。